—
HPI - Stredoeurópsky inštitút pre zdravotnú politiku > Publikácie > Zdravotníctvo – trhy, regulácia, politika > Špecifický prípad z oblasti regulácie a organizácie: Lieková politika
Špecifický prípad z oblasti regulácie a organizácie: Lieková politika
nedeľa, 07. júl 2013, 23:50 — Angelika Szalayová

Táto kapitola sa venuje regulácii farmaceutického trhu a tvorbe liekovej politiky. Zdôvodňuje, prečo je farmaceutický trh jeden z najviac regulovaných trhov, a vysvetľuje, aké mechanizmy sa používajú pri regulácii vstupu liekov na trh, tvorbe cien, predaji, predpisovaní aj užívaní liekov.
 |
OBSAH KAPITOLY: |
1. Regulácia farmaceutického trhu, dôvody a ciele regulácie liekov
Farmaceutický trh je unikátny so zreteľom na rozsah a hĺbku, akým neplní kritériá dokonalého trhu (Abel-Smith a Grandjeat 1978; Jacobzone 2000; Dukes et al. 2003). Na farmaceutickom trhu existujú nedostatky na strane ponuky (väčšinou v súvislosti s patentovou ochranou, spracovaním a dĺžkou schvaľovania regulačnými úradmi a vernosťou značke) aj dopytu (existuje tu štvorstupňová štruktúra dopytu, kde lekár liek predpíše, lekárnik ho vydá, pacient spotrebuje a poisťovňa zaplatí).
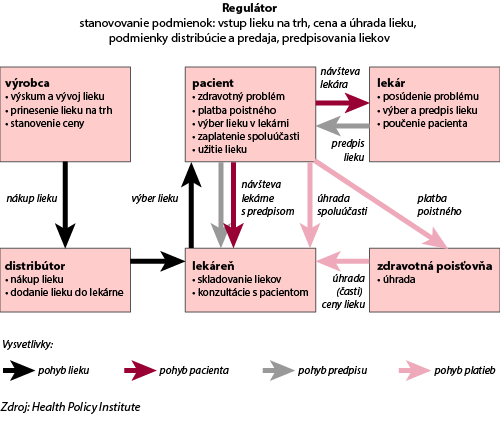
Regulácia farmaceutického trhu je zložitý systém, ktorý zahŕňa dynamickú súhru viacerých subjektov (Schéma 1):
- výrobcu lieku – vyvíja, testuje a vyrába lieky, prináša ich na trh a navrhuje ich cenu
- distribútora lieku – nakupuje lieky od výrobcu a distribuuje do lekární
- lekára – vyberá najvhodnejší liek pre pacienta, poskytuje mu informácie o potrebe liečby a spôsobe užívania lieku
- lekárnika – nakupuje lieky od distribútora, zabezpečuje ich dostupnosť v lekárni a vydáva pacientom, poskytuje konzultácie pacientom
- pacienta – platí si zdravotné poistenie, prichádza so zdravotnými problémami za lekárom, vyzdvihne si liek v lekárni a prípadne za neho zaplatí celú alebo len časť ceny, užíva liek
- zdravotnej poisťovne – na základe poistenia pacienta uhrádza celú alebo časť ceny lieku, kontroluje oprávnenosť predpísania lieku
- regulátora – stanovuje podmienky pre vstup lieku na trh, cenu a úhradu lieku, podmienky distribúcie a predaja a predpisovania liekov
Schéma 1: Farmaceutický trh
Na rozdiel od farmaceutického trhu, dokonalý trh funguje efektívne a účinne. Podlieha cenovej konkurencii, existujú úplné a presné informácie, ktoré sú k dispozícii pre všetky zúčastnené strany, je dostatočný prísun a ponuka liekov, spotrebitelia sú schopní robiť informované a prospešné rozhodovanie medzi konkurenčnými produktmi a neexistujú žiadne prekážky pre vstup produktov na trh. V skutočnosti však farmaceutický trh ako taký zlyháva. Najdôležitejšie dôvody zlyhania, pre ktoré je farmaceutický trh jedným z najregulovanejších odvetví, sú:
- spotrebiteľ zvyčajne nerozhoduje o svojich farmaceutických potrebách, lieky pre neho predpisuje lekár, ktorého rozhodnutia okrem najlepšieho záujmu pacienta môžu byť ovplyvnené aj jeho osobnými záujmami
- existuje informačná asymetria medzi spotrebiteľmi a poskytovateľmi zdravotnej starostlivosti, poskytovateľmi zdravotnej starostlivosti a výrobcami, a rovnako aj medzi výrobcami a regulátorom.
- dochádza k zlyhaniu konkurencie, pretože trh je vytvorený prostredníctvom výhradných práv (patenty) a na trhu existujú monopoly pre výrobky, ktoré až do expirácie patentu bránia cenovej konkurencii na trhu (niektoré podtrhy (v zmysle terapeutických skupín) môže ovládať jedna alebo dve farmaceutické spoločnosti)
- vysoké náklady na výskum a vývoj, ktorých výsledkom sú informácie, z ktorých dokáže profitovať každý a stávajú sa verejným statkom
- v zdravotníctve a pri používaní liekov sú časté externality, kedy zdravotná starostlivosť (napr. imunizácia, liečba prenosných chorôb) je prínosom nielen pre ľudí, ktorí ju používajú, ale aj pre ostatných ľudí (znížené riziko nakazenia); benefit liečby jednotlivca môže byť dokonca vyšší pre celú spoločnosť než pre neho samotného, preto má spoločnosť motiváciu takéto činnosti regulovať a nenechať ich na samoreguláciu trhom
- existencia zdravotného poistenia alebo solidárnych daňových systémov financovania zdravotníctva zásadne deformuje motivácie jednotlivých účastníkov trhu a je príčinou morálneho hazardu.
Regulácia liekov vychádza z prirodzených vlastností týchto produktov. Ide najmä o významné, ale neisté riziká a prínosy pre zdravie. Informácie o prínosoch a rizikách liekov je možné získať len po dôkladnom štúdiu na veľkom počte pacientov s príslušnou kontrolou. Hlavným argumentom pre reguláciu je skutočnosť, že štruktúra a interpretácia týchto údajov je verejným statkom, ktorý je najlepšie poskytovaný odborníkmi regulačného úradu. Konsenzus na túto tému dokazuje aj existencia regulačných systémov vo všetkých vyspelých a väčšine rozvojových krajín. Názory sa mierne líšia v tom, aké informácie o liekoch získavať a za akých podmienok sprístupniť liek verejnosti.
Charakteristickou pre farmaceutický trh je dominantná úloha platby tretej strany prostredníctvom daňového systému, verejného alebo súkromného zdravotného poistenia. Rovnako ako pri každom poistení, vzniká morálny hazard, so stimulmi pre spotrebiteľov k nadmernej spotrebe a/alebo používaniu zbytočne drahých liekov. Okrem toho poistenie vytvára stimuly pre farmaceutické firmy účtovať vyššie ceny, než aké by mali v prípade neexistencie poistenia. V reakcii na tieto deformácie spôsobené poistením vlády vytvorili komplikované regulačné systémy na kontrolu výdavkov na lieky najmä prostredníctvom regulácie cien výrobcov, celkových výdavkov na lieky alebo výnosov priemyslu.
Úlohy a ciele vlády v regulácii farmaceutického trhu sú zložité a rôznorodé. Úlohou liekovej politiky je zabezpečiť dostupnosť účinných, bezpečných a kvalitných liekov za ceny, ktoré sú dostupné, a nájsť rovnováhu medzi protichodnými záujmami a cieľmi jednotlivých zúčastnených strán. Regulátor musí zabezpečiť ochranu verejného zdravia, prístup pacientov k bezpečným a účinným liekom, zlepšenie kvality starostlivosti a zároveň zabezpečiť, aby farmaceutické výdavky nerástli natoľko, aby to narušilo tieto a ďalšie ciele. Medzi hlavné princípy patrí aj solidarita a efektívnosť (t.j. čo najlepšie využitie obmedzených zdrojov na zvýšenie zdravotného stavu obyvateľstva) a plnenie zdravotných potrieb pacientov.
V širšom význame je cieľom liekovej politiky:
- zlepšenie zdravotného stavu obyvateľstva a plnenie jeho zdravotných potrieb
- efektívnosť využívania zdrojov
- dostupnosť účinných a kvalitných liekov
- kvalita zdravotnej starostlivosti
- finančná udržateľnosť
- solidarita
Vo svete sa používa široká škála opatrení a nástrojov na dosiahnutie týchto cieľov. Najbežnejšie sú používané opatrenia na strane ponuky zamerané predovšetkým na kontrolu vstupu lieku a na ceny a úhrady liekov. Kontrola cien je zvyčajne založená na vonkajšej (medzinárodné porovnanie) alebo na vnútornej referencii (existujúca liečba). Novým trendom je zapojenie ekonomických analýz do rozhodovania o cene, kedy sa porovnávajú náklady aj zdravotné prínosy nových liečebných postupov. Ďalšie používané nástroje zahŕňajú rabaty, zľavy, vrátenie peňazí alebo dohody o cene a objeme (price-volume agreements). Niektoré krajiny majú zavedené systémy kontroly zisku, kde sa nereguluje cena lieku priamo, ale celkový zisk farmaceutickej spoločnosti. Úhrada je regulovaná pomocou pozitívnych alebo negatívnych zoznamov a schém zdieľania nákladov so spotrebiteľmi v podobe spoluúčasti.
O niečo menej sú využívané opatrenia na strane dopytu. Lekári, pacienti a lekárnici hrajú dôležitú úlohu v racionálnom využívaní liekov, a preto musia byť aktívne zapojení do farmaceutickej politiky. Až doteraz sa pri ich regulácii používali skôr „mäkké“ nástroje – napríklad terapeutické odporúčania alebo vzdelávacie programy na ovplyvňovanie správania predpisujúcich lekárov. Tieto opatrenia sa však neukázali ako účinné oproti „tvrdým“ nástrojom ako sú napr. finančné stimuly motivujúce lekára k racionálnejšiemu využívaniu zdrojov. Na strane pacienta ide o rôzne druhy schém zdieľania nákladov (spoluúčasť, pripoistenie, úvodná spoluúčasť), ktoré napomáhajú tomu, aby si pacienti uvedomovali náklady spojené so zdravotnou starostlivosťou a znižoval sa morálny hazard pri užívaní liekov. Lekárnici tiež môžu zohrávať dôležitú úlohu, a to predovšetkým prostredníctvom využívania generickej substitúcie.
Tabuľka 1: Ciele a typy regulácie farmaceutického trhu
|
Dôvod pre reguláciu |
Typ regulácie |
|
Nedokonalé informácie o bezpečnosti a účinnosti liekov |
Regulácia vstupu na trh, požiadavky na bezpečnosť, účinnosť a kvalitu Regulácia marketingu a propagácie Zodpovednosť |
|
Vysoké fixné náklady na výskum a vývoj |
Patenty a regulácia, vstup generických liekov Špeciálna regulácia pre lieky na zriedkavé ochorenia |
|
Poistením indukovaný morálny hazard |
Regulácia cien, úhrady, regulácia ziskov a liekových limitov Spoluúčasť pacientov |
|
Zlyhanie konkurencie |
Regulácia cien, úhrady, regulácia ziskov a liekových limitov Regulácia predpisovania liekov Regulácia distribúcie a výdaja liekov |
|
Rozhodovanie tretími stranami |
Regulácia cien, úhrady, regulácia ziskov a liekových limitov Regulácia predpisovania liekov |
|
Externality |
Regulácia predpisovania a užívania liekov |
Zdroj: HPI podľa Danzon et al. 2007, 2010
Niektoré z cieľov liekovej politiky môžu byť vo vzájomnom konflikte – napríklad zvýšenie prístupu k službám a zlepšenie kvality zdravotnej starostlivosti môže znamenať zvýšenie nákladov, ale zároveň môže zvýšiť efektívnosť. Prakticky žiadne z existujúcich regulačných opatrení nie je bez negatívneho efektu na niektorý z iných cieľov. Tvorcovia liekovej politiky preto musia jednotlivým cieľom prisúdiť úroveň ich priority a pri zavádzaní nových opatrení si musia byť vedomí aj následných negatívnych dopadov v ostatných oblastiach. Ak sú tieto negatívne dopady väčšie ako benefity v iných dimenziách, zavedenie opatrenia je potrebné prehodnotiť.
Neexistuje žiadne dokonalé riešenie pre vyváženie všetkých cieľových oblastí v liekovej politike. Dokonca aj keď tvorcovia zdravotnej a liekovej politiky vedia, ako tieto ciele vyvážiť, žiadne opatrenie alebo skupina opatrení nie je správna pre všetky krajiny a prostredia. Každá krajina si preto musí vyberať regulačné opatrenia na základe svojich vlastných cieľov a potrieb.
2. Vstup liekov na trh
2.1 Regulácia vstupu na trh
Schválenie vstupu na trh je nevyhnutnou podmienkou predaja všetkých liekov, bez ohľadu na to, či sú voľnopredajné alebo viazané na lekársky predpis. Hoci je táto požiadavka navrhnutá tak, aby bola zaistená bezpečnosť a účinnosť liekov, schválenie vstupu na trh má negatívne dôsledky v zmysle časového oneskorenia a dodatočných nákladov na schválenie (testovanie a poplatky).
Hlavnými otázkami pre vstup lieku na trh sú:
- koľko informácií o rizikách a prínosoch je potrebné mať k dispozícii pred uvedením lieku na trh,
- aký je akceptovateľný pomer medzi prínosmi a rizikami
- aká je vhodná kombinácia preregistračného a postregistračného sledovania prínosov a rizík a aké metódy majú byť pri tom použité
Lieky ako jedny z mála produktov majú veľmi prísne kontrolovaný vstup na trh. Tento stav je výsledkom historického vývoja v posledných 100 rokoch. Na začiatku bol kladený dôraz na preukázanie bezpečnosti, neskôr aj účinnosti. V súčasnosti sa do popredia dostáva aj prínos lieku oproti ostatným alternatívam. Metódy používané pri rozhodovaní sa postupne vyvíjali a dnes predstavujú sadu postupných krokových schvaľovaní vstupu liekov na trh.
Rámček 1: Počiatky regulácie vstupu liekov na trh v USA
|
Regulácia vstupu liekov na trh sa začala v USA v roku 1907 zákonom (Pure Food and Drug Act), ktorý okrem iného zakazoval výrobu, transport a predaj jedov ako liekov a vyžadoval označovanie liekov obsahujúcich niektoré špecifikované látky ako alkohol, kokaín a opiáty. Ďalšia zmena regulácie nastala po sérii viac ako 100 úmrtí po užití lieku so sulfanylamidom, ktorý výrobca rozpustil v etylénglykole a predával ho bez toho, aby overil, či etylénglykol nie je toxický pre ľudí alebo zvieratá. Testovanie toxicity na zvieratách bolo v tom čase síce štandardnom, avšak nebolo nevyhnutné alebo vyžadované zákonom. Už po pár dňoch od zahájenia predaja došlo k viacerým úmrtiam, na základe ktorých sa začalo vyšetrovanie. Keďže výrobca neporušil žiaden zákon tým, že netestoval toxicitu lieku, v následnom súdnom procese dostal len malú pokutu za nesprávne označenie výrobku ako „elixír“, ktorý bol vyhradený len pre výrobky obsahujúce alkohol. To bol v tom čase tiež jediný dôvod, pre ktorý mohli predaj tohto produktu zakázať. Ako dôsledok tohto a podobných prípadov prijal americký kongres v roku 1938 ďalší zákon (Food, Drug, and Cosmetic Act), ktorý autorizoval už vtedy existujúci Úrad pre lieky a potraviny (Food and Drug Administration, FDA), aby kontroloval bezpečnosť potravín, liekov a kozmetických prípravkov. Tento zákon s mnohými neskoršími dodatkami platí v USA dodnes. Pôvodná verzia zákona umožňovala FDA zakázať predaj liekov, ak neboli uznané za bezpečné. V prípade, ak FDA nevydal rozhodnutie do 180 dní, výrobca mohol začať s predajom lieku aj bez povolenia. Napriek tejto slabej pozícii sa vďaka tejto regulácii FDA podarilo úspešne oddialiť zahájenie predaja Thalidomidu v roku 1961, pretože žiadal doloženie ďalších štúdií o bezpečnosti lieku. Thalidomid sa v roku 1959 začal predávať v Nemecku a niektorých ďalších krajinách Európy a celého sveta ako liek na nevoľnosť počas tehotenstva. Liek sa používal 4 roky, pokým sa podarilo preukázať, že je zodpovedný za vznik vrodených vývojových chýb detí narodených matkám, ktoré ho počas tehotenstva užívali. Predpokladá sa, že na celom svete sa narodilo 10 000 až 20 000 detí s postihnutím spôsobeným Thalidomidom. Po Thalidomidovej kauze sa podmienky ešte viac sprísnili a dostali podobu, ktorá je v princípe používaná dodnes. Zároveň sa zrušila možnosť uviesť liek na trh, ak úrad nevydá rozhodnutie do 180 dní a od liekov sa okrem preukázania bezpečnosti začalo vyžadovať aj preukázanie účinku. |
Vývoj regulácie vstupu liekov na trh vo vyspelých európskych krajinách kopíroval vývoj v USA (v Rámčeku 1). Zavádzanie regulácií prebiehalo v každom štáte samostatne a podmienky medzi štátmi sa mierne líšili. V roku 1995 vznikla v Európe spoločná Európska lieková agentúra (European Medicines Agency, EMEA) s cieľom vytvorenia centralizovaného postupu pri schvaľovaní liekov pre členské štáty EÚ. EMEA umožňuje dva spôsoby schvaľovania liekov. Centralizovaná procedúra zahŕňa preskúmanie lieku v EMEA a poskytuje simultánne schválenie lieku vo všetkých krajinách EÚ. Alternatívne je možné využiť procedúru vzájomného uznávania, ktorá umožňuje schválenie agentúrou jednej členskej krajiny s prenosom do iných členských krajín, ak tieto krajiny nevznesú proti vstupu námietku. Prípadné konflikty v takomto prípade rieši EMEA. Pre vybrané skupiny liekov (ako sú biotechnologické produkty a lieky na zriedkavé ochorenia – orphan drugs) je centralizovaná procedúra nevyhnutná. Schvaľovanie na národnej úrovni sa v súčasnosti využíva zvyčajne už len v prípadoch, kedy sa plánuje liek marketovať len v malom počte krajín EÚ.
Súčasný systém povoľovania vstupu nových liekov na trh má niekoľko postupných fáz hodnotiacich účinnosť a bezpečnosť liekov (Rámček 2, Schéma 2). Pred zahájením klinických štúdií na ľuďoch musí výrobca preukázať bezpečnosť látky in vitro (v skúmavkách) a in vivo (na tkanivových kultúrach alebo zvieratách). Tieto štúdie majú za cieľ študovať toxicitu, ktoré orgány sú ovplyvnené látkou a či sa môžu vyskytnúť dlhodobé karcinogénne účinky a toxické účinky na reprodukciu cicavcov.
Po priaznivých výsledkoch z predklinických štúdií sa môže začať testovanie na ľuďoch, ktoré prebieha v 4 fázach klinických štúdií, pričom 4. fáza prebieha až po povolení vstupu lieku na trh (registrácii lieku) ako tzv. postmarketingová fáza klinického skúšania. V súčasnosti na každých približne 10 000 syntetizovaných molekúl bude len asi 15 až 40 testovaných na toxicitu a len 2 až 3 uspejú aj v klinických štúdiách na účinnosť a len 1 pri testovaní dlhodobej toxicity.
Čas trvania testovania liekov pred získaním povolenia vstupu na trh sa vplyvom rozširujúcich sa regulácií predĺžil na niekoľko rokov. Kým v 60-tych rokoch minulého storočia to bolo priemerne 4,7 roka, v 90-tych rokoch až 9,1 roka (DiMasi et al. 1995, Kaitin et al. 1994) a v súčasnosti je to viac ako 10 rokov. To samozrejme so sebou prinieslo aj zvýšenie nákladov na vývoj liekov, ktoré sa následne prejavuje v ich vyššej cene.
Rámček 2: Testovanie liekov pred vstupom na trh
|
Schéma 2: Testovanie liekov pred vstupom na trh – časová schéma
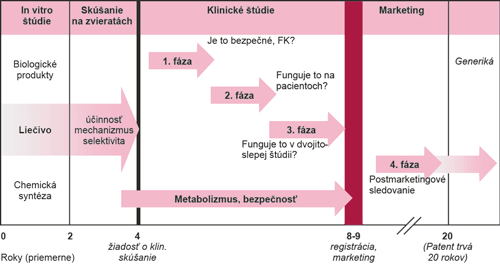
Vysvetlivky: FK – farmakokinetika
Rozhodnutie o vydaní povolenia alebo zamietnutí vstupu lieku na trh je spojené s veľkou neistotou. Klinické testovanie spojené so štatistickými analýzami zlepšuje podmienky pre urobenie správneho rozhodnutia, ale nedokáže eliminovať neistotu úplne, najmä pre nežiaduce účinky s veľmi nízkym výskytom. Pre regulátora je prirodzene prijateľnejšie urobiť chybu II. typu (nepovoliť vstup bezpečnému lieku) ako I. typu (povoliť vstup nebezpečnému lieku). To môže viesť k tomu, že sa pacienti nedostanú k účinným liekom alebo sa k nim dostanú oneskorene, ale aj k ďalej sa zvyšujúcim nákladom na výskum a vývoj, napr. rozširovaním rozsahu klinických štúdií (Scherer 1996, Peltzman 1973).
Proces hodnotenia liekov pri jeho vstupe na trh je považovaný za nedostatočný aj z dôvodu nedostatočného porovnávania terapeutickej hodnoty nových liekov voči existujúcim liekom. Hodnotenie sa často zakladá na porovnávaní lieku s placebom. Výsledkom je, že mnohé schvaľované lieky neprinášajú žiaden dodatočný benefit a to často aj napriek ich vyššej cene. Analýza 12 protirakovinových liekov schválených EMEA v rokoch 1995 a 2000 ukázala, že tieto lieky boli hodnotené v malých štúdiách s preukázaním ekvivalencie alebo nie horších výsledkov oproti referenčným liekom. Výsledky týchto štúdií boli hodnotené v krátkodobom horizonte a subjektívne (Garattini a Bertele 2002).
2.2 Patentová ochrana
Tak ako v inom priemysle, aj pri výrobe liekov je motiváciou vývoja nových liekov možnosť získať profit pri jeho predaji. Investori a farmaceutické firmy budú ochotné investovať veľké sumy peňazí a roky venované výskumu len vtedy, ak budú mať šancu pri ich predaji získať naspäť investované prostriedky spolu s adekvátnym profitom (ziskom).
Pri väčšine priemyslu musí imitátor zopakovať celý alebo takmer celý proces výskumu a vývoja, aby bol schopný skopírovať existujúci inovatívny produkt. Táto skutočnosť a časový náskok, ktorý umožňuje budovať lojalitu klientov, sú často dostatočné na to, aby sa inovátorovi oplatilo investovať do výskumu a vývoja. Pri liekoch však väčšinu výskumu a vývoja nie je potrebné opakovať (výber a testovanie molekúl). Neexistencia patentovej ochrany by preto poskytovala výrazné benefity pre imitátorov a investované náklady by sa výrobcom nevrátili, čo by ich odradilo od ďalšieho výskumu a vývoja.
Práva duševného vlastníctva (intellectual property rights, IPR) udeľujú inovátorovi určité výlučné práva na vynálezy, ochranné známky a pod. V prípade patentov, ktoré poskytujú ochranu práv duševného vlastníctva pre farmaceutické inovácie, práva trvajú 20 rokov. Po tomto čase sa inovácia stáva verejným vlastníctvom. Ide o kompromis medzi odmeňovaním inovácie s cieľom maximalizácie vedeckého pokroku a prístupom k technológiám. Farmaceutické firmy môžu získať späť svoje náklady vynaložené na výskum a vývoj a pokryť zodpovedajúce riziká svojich investícií. Na druhej strane sa podporuje všeobecná hospodárska súťaž po uplynutí doby platnosti patentu. Stručne povedané, ochrana duševného vlastníctva je nevyhnutným predpokladom na zabezpečenie toho, aby inovatívne firmy mohli pokračovať vo vývoji nových liekov.
Z pohľadu originality na trhu preto rozlišujeme 2 typy liekov – originálne a generické lieky. Originálny liek je liek, ktorý bol inovatívne vyvinutý a jeho výrobca vlastní patent. Generické lieky sú naopak kópiami originálnych liekov, ktoré môžu začať ostatné farmaceutické firmy vyrábať po skončení platnosti patentu. V niektorých prípadoch sa vlastník patentových práv môže rozhodnúť umožniť výrobu generického lieku iným farmaceutických firmám už pred vypršaním patentu, spravidla za finančnú odmenu. Takéto lieky sa potom nazývajú licencované generiká.
Na povolenie vstupu generického lieku na trh nie je potrebné dlhoročné testovanie v klinických štúdiách, pretože tieto informácie sú známe. Klinické skúšanie pre generické lieky vyžaduje len potvrdenie rovnakej biologickej dostupnosti s originálnym liekom (tzv. bioekvivalenčné štúdie).
Nie každý originálny liek prináša zásadnú inováciu. Časť nových liekov sú tzv. „me-too drugs“. Ide o liečivé látky, ktoré majú podobnú chemickú štruktúru ako iné existujúce lieky a podobný terapeutický účinok. Spravidla prinášajú aj mierne zlepšenie oproti pôvodnému lieku (napr. majú silnejší účinok alebo menšie nežiaduce účinky).
Patenty nie sú jediným možným spôsobom odmeňovania za výskum a vývoj vo farmaceutickom priemysle. Alternatívnym prístupom môže byť odmeňovanie výskumných projektov napr. formou grantových projektov. Samozrejme, účinnosť takýchto systémov závisí od stimulov a motivácií autorít udeľujúcich takéto granty. Ďalšou alternatívou je udeľovanie odmien za úspešné inovácie, ktoré spĺňajú vopred stanovené kritériá. Iným riešením by bolo zachovanie práva na patent, ale vlády alebo veľké zdravotné poisťovne by odkúpili od majiteľa patentové práva a potom vyrábali lieky vo vlastnej réžii za marginálne náklady. Tento prístup by tak eliminoval rozdiely medzi nákladmi a cenou vplyvom trhovej sily ako aj náklady na marketing, ktoré predstavujú významnú položku nákladov na lieky. Vzhľadom k tomu, majiteľ patentu by predával lieky za menej ako je súčasná diskontovaná hodnota budúcich príjmov z patentu, stimul k inováciám by bol plne zachovaný. Takýto systém dnes existuje na Novom Zélande. Takýto systém by mal však aj svoje nevýhody. Majitelia patentu by boli málo motivovaní investovať do marketingu a informácie o nových liekoch a liečebných postupoch by mali nízku penetráciu. Bolo by tiež ťažké zabrániť inej vláde alebo poisťovni, aby využívali prístup k takto zakúpenej lacnej technológii (paralelnému obchodu).
3. Cenotvorba liekov a úhrada zo zdravotného poistenia
3.1 Regulácia cien liekov
Patentová ochrana garantuje investorom nového lieku monopol na predaj ich inovácie. Aj keď tento monopol má limitované trvanie, je v protiklade s princípmi dokonalej konkurencie.
Aj v prípade, ak lieky nie sú hradené zdravotným poistením, spotrebitelia a najmä bohatí spotrebitelia z vyspelých krajín, sú ochotní zaplatiť vysokú cenu, aby sa vyhli bolesti, znížili riziko vzniku infarktu alebo odstránili nepríjemnú infekciu. Dopyt po mnohých liekoch je pomerne neelastický do relatívne vysokých cien, kým sa prejaví vplyv príjmov na elasticitu (Berndt et al. 1995, Ellison etal. 1997). Kombinácia tejto nízkej elasticity a existencia monopolov na strane ponuky vytvára podmienky pre stanovenie cien vysoko nad reálne náklady.
Rovnako ako v iných odvetviach priemyslu, farmaceutické spoločnosti používajú ceny ako strategický nástroj pre optimalizáciu svojho zisku. Inovačné lieky sú skôr vedomostné produkty (podobne ako počítačové programy). Väčšinu nákladov na uvedenie výrobku na trh, predstavujú náklady na výskum a vývoj a náklady na marketing a propagáciu. Výrobné náklady sú v porovnaní s nimi často zanedbateľné. Preto ceny nových liekov nie sú založené na nákladoch na syntézu chemických látok a lisovanie liekov – ale skôr na spoločenských nákladov problému, ktorý sa snažia riešiť a na ochote spotrebiteľov a zdravotníckych systémov platiť za liek.
Výrobcovia generických liekov nemusia znášať náklady na výskum a vývoj, preto dokážu produkovať rovnaké lieky za výrazne nižšie náklady než originálny výrobca. Po vstupe generika na trh (pri existencii cenovej citlivosti) je preto originálny výrobca motivovaný znížiť cenu na úroveň cien imitátora.
Na typických trhoch je „spravodlivá“ cena produktu výsledkom neustále prebiehajúceho procesu „vyjednávania“ medzi dodávateľom a užívateľom. Výsledok tohto procesu závisí na sile zúčastnených strán. Pri farmaceutickom trhu naopak nemôže existovať žiadne skutočné vyjednávanie medzi pacientom a dodávateľom liekov. Pacient nie je schopný vstúpiť do takých rokovaní. Voľná tvorba cien liekov by pri takto deformovanom trhu preto bola spojená s vysokou úrovňou cien. Väčšina krajín preto aplikuje v určitej podobe cenovú reguláciu.
Pri rozhodovaní sa o cene farmaceutické firmy robia najprv podrobný prieskum trhu a uplatňujú moderné ekonomické modely na stanovenie ceny, pričom musia zohľadniť existenciu a vplyvy rôznych administratívnych opatrení. Pri generických liekoch sa ceny začínajú približne o 20-30 % nižšie ako sú ceny originálnych liekov. Vďaka konkurencii medzi viacerými výrobcami táto cena zvyčajne ešte ďalej významne klesá.
Niekedy môže cena originálnych liekov po skončení patentovej ochrany rásť aj súčasne so vstupom lacnejších generík na trh. Vyplýva to z existencie dvoch paralelných trhov, z ktorých jeden je citlivý na ceny (a po vstupe generík využíva existenciu lacnejších alternatív) a druhý je k cenám ľahostajný, lebo dopyt je lojálny značke. Z tohto dôvodu niektoré farmaceutické firmy vstupujú na trh s vlastným generikom s iným názvom a s nižšou cenou a zároveň ponechávajú na trhu originálny liek za pôvodnú (alebo aj vyššiu) cenu.
Regulácia cien má za cieľ zabezpečiť, aby ceny liekov boli „adekvátne“ pre daný systém zdravotníctva. Takmer vo všetkých ekonomicky vyspelých krajinách na svete, s výnimkou Veľkej Británie a Nemecka, je dohoda o cene podmienkou vstupu lieku na trh financovaný z verejných zdrojov. Väčšina v súčasnosti používaných systémov regulácie cien nezohľadňuje pridanú terapeutickú hodnotu konkrétneho lieku. Ideálny systém by mal odmeňovať cenami lieky v závislosti od marginálnych prínosov lieku, aby bolo možné ohodnotiť skutočnú inováciu a zisk klinickej účinnosti. Takéto opatrenia zohľadňujú stúpajúci tlak na rozpočty na lieky ako aj zameranie sa na získanie hodnoty za vynakladané finančné prostriedky.
Cenotvorba je hlavným strategickým nástrojom pre firmy a ceny liekov sú predmetom tvrdého vyjednávania medzi výrobcami, regulátormi a kupujúcimi. Vo svete sa používajú rôzne modely ako medzinárodné porovnávanie cien (napr. Slovensko, Česká republika, Grécko, Írsko, Portugalsko ), kombinované dohody o cene a objeme (napr. Francúzsko), regulácia zisku farmaceutických firiem (napr. UK) alebo stanovovanie cien na základe nákladovej efektívnosti (napr. Austrália, Holandsko). Niekedy dáva firma zľavy hlavným odberateľom za veľký objem zákazky alebo za výhodnejšiu pozíciu na liekovom formulári alebo ceny dvoch alebo viacerých liekov sú súčasťou jednej dohody. Táto rozmanitosť cenových rokovaní spôsobuje neochotu farmaceutického priemyslu zverejniť podrobné informácie o cenách, ktoré by mohli oslabiť ich vyjednávaciu pozíciu oproti kupujúcim stranám.
Niektorí ekonómovia navrhujú modely cenotvorby v závislosti na ekonomickej sile. To znamená, že cena nových liekov by mala byť definovaná na základe schopnosti platiť, napríklad zohľadnením výšky HDP na obyvateľa danej krajiny. Farmaceutický priemysel však nie je takýmto modelom naklonený, pretože výrobcov oberá o slobodu stanoviť si cenu. Hlavným rizikom pri tom je, že krajiny s vyššími cenami by nakupovali a dovážali lieky z krajín s nižšími cenami. Výsledkom by bolo, že farmaceutický priemysel by nemal možnosť získať za inováciu dostatočný zisk a lieky by sa stali v krajinách s nízkymi cenami nedostupné, vzhľadom na zvýšený dopyt pokrývajúci aj potreby iných krajín. Rozdiely v ekonomickej sile a schopnosti platiť za lieky pre rozvojové krajiny preto farmaceutický priemysel radšej rieši nesystémovými formami ako programami pomoci, darmi, prípadne dobrovoľnými licenciami pre miestne generické firmy.
Vo všeobecnosti empirické dôkazy naznačujú, že prísne režimy priamej cenovej regulácie môžu byť efektívne pri kontrole rastu cien liekov pri pohľade na cenovú úroveň v jednotlivých krajinách, ale ich efekt nie je taký významný pri kontrole celkových výdavkov, pokiaľ sa nepoužívajú v kombinácii s inými regulačnými opatreniami. Dôvodom je neutralizácia prípadných úspor veľkým nárastom objemu. Príčinou nárastu nákladov na lieky nie je primárne nárast cien, ale zvýšenie objemu predpisovania a zavádzanie nových produktov (Nefarma 2002). Aj v krajinách, ktoré používajú dohody o cene a objeme (napr. Španielsko a Taliansko), bývajú rozpočty pravidelne prekračované (Donatini et al. 2001).
3.2 Regulácia úhrady zo zdravotného poistenia a spoluúčasť
Stanovenie úhrady lieku zo zdravotného poistenia odráža výsledok rokovania medzi farmaceutickými spoločnosťami s novým liekom (monopol) a platiteľom – spravidla vládou alebo zdravotnou poisťovňou (monopsony). Výsledná výška úhrady odráža politickú a ekonomickú silu oboch strán a ich rokovacie schopnosti. Rozhodnutie o úhrade a jej výške spravidla znamená aj stanovenie výšky spoluúčasti pacienta. Úhrada môže byť vnímaná ako ďalší prostriedok odmeňovania inovácií, kedy sú nové produkty hodnotené z hľadiska ich skutočného klinického prínosu prémiou vo forme úhrady.
Stanovenie úhrady zo zdravotného poistenia a jej výšky by malo byť spojené s hodnotením dopadov na rozpočet na lieky, resp. rozpočet na lieky by sa mal prispôsobiť takýmto rozhodnutiam[1].
V rámci EÚ sú systémy úhrad relatívne podobné – princípom je vo väčšine prípadov zaradenie alebo nezaradenie lieku na pozitívny zoznam na základe rozhodnutia regulátora alebo ním poverenej inštitúcie. Medzi jednotlivými krajinami však existujú výrazné rozdiely v tom, čo má a čo nemá byť hradené a líšia sa aj kritériá na posudzovanie liekov. Z tohto dôvodu nie je pravdepodobné, že by v najbližšom období došlo k centralizácii takéhoto posudzovania na úrovni EÚ ako je to v prípade schvaľovania vstupu liekov na trh.
Zdieľanie nákladov na lieky formou spoluúčasti pacienta je súčasťou všetkých systémov úhrad vo vyspelých krajinách. Spoluúčasť bola zavedená v snahe kontrolovať farmaceutické výdavky a ovplyvňovať dopyt po liekoch na predpis. Existujú v princípe 4 rôzne formy zdieľania nákladov a ich kombinácie:
- percentuálna spoluúčasť – najbežnejšia forma, keď pacient platí určité percento z ceny lieku
- fixná spoluúčasť – pacient platí fixnú sumu za každú položku alebo recept bez ohľadu na cenu liekov
- odpočítateľné položky (úvodná spoluúčasť) – pacient hradí počiatočné náklady do určitej sumy, pri ktorej už jeho výdavky na lieky preberá platiteľ (zdravotná poisťovňa)
- spoluúčasť ako súčasť referenčného systému úhrad, kedy pacient platí rozdiel medzi cenou lieku a referenčnou úhradou
Zdieľanie nákladov zvyšuje efektivitu tým, že sa zníži nadmerný dopyt a regulujú sa celkové výdavky na lieky. Pacient je citlivý na cenu a preto sa usiluje o to, aby mal čo možno najnižšie náklady na liečbu. Ak existujú alternatívne liečebné postupy, môže citlivosť jednotlivcov na ceny viesť k nižším cenám. Zavedenie spoluúčasti pomáha predchádzať používaniu zbytočných (a často aj pre pacienta škodlivých) liekov, pretože jednotlivci uprednostnia liečbu a zásahy, ktoré majú pre nich vysokú hodnotu. V mnohých krajinách existujú výnimky pre ohrozené skupiny (definované na základe veku, príjmu a klinického stavu) alebo „záchranné“ mechanizmy ako maximálny limit spoluúčasti za rok. Existencia doplnkového dobrovoľného zdravotného poistenia v niektorých krajinách pokrývajúca drvivú väčšinu populácie (napr. Francúzsko, Chorvátsko, Slovinsko) však odstraňuje tieto cenové stimuly zamerané na zníženie dopytu.
Nedostatky regulačnej funkcie spoluúčasti vyplývajú z deformácie farmaceutického trhu vplyvom informačnej asymetrie, preneseného dopytu a jeho rôznorodosti. Dopyt po zdravotnej starostlivosti je do značnej miery určený predpisujúcim lekárom, preto opatrenia, ktoré sa zameriavajú na dopyt spotrebiteľov, nemusia byť rovnako účinné v ovplyvňovaní spotreby ako tie, ktoré sa zameriavajú na ponuku alebo ovplyvnenie dopytu cez preskribujúceho lekára. Zdieľanie nákladov tiež spôsobuje zmenu v solidarite pri rozdeľovaní zdravotných benefitov, pretože pre nízko príjmové skupiny môže byť miera spoluúčasti bariérou prístupu k zdravotnej starostlivosti. Z tohto dôvodu sú mechanizmy na ochranu pred vysokými nákladmi veľmi dôležité.
Použitie spoluúčasti spravidla plní 3 funkcie:
- dáva povinnosť pacientom uhradiť časť nákladov na ich lieky, a tým znižuje finančnú záťaž pre verejné financie
- zvyšuje povedomie pacientov o nákladoch na zdravotnú starostlivosť
- odrádza pacientov od používania príliš veľkého množstva liekov alebo príliš drahých liekov
Rozdiel medzi klasickou spoluúčasťou a spoluúčasťou pri systéme referenčných úhrad je v tom, že pri referenčných úhradách sa môže pacient spravidla vyhnúť priamej platbe výberom lacnejšieho lieku, pričom pri ostatných typoch spoluúčasti je priama platba povinná a nedá sa jej vyhnúť. Spoluúčasť sa zvyčajne používa v kombinácii s pozitívnym zoznamom.
3.3 Referenčný systém úhrad
Referenčný systém úhrad je spôsob stanovenia limitov na výšku úhrady liekov pri existencii alternatívnych liekov na trhu. Pre každú skupinu konkurenčných (alternatívnych) liekov sa stanoví maximálna výška úhrady (referenčná úhrada). Ak je cena akéhokoľvek lieku vyššia ako referenčná úhrada, z verejných zdrojov sa hradí cena lieku len do tohto limitu a rozdiel medzi cenou lieku a jeho úhradou zdieľa pacient.
Referenčný systém úhrad motivuje pacienta a cez neho aj predpisujúceho lekára vybrať si lacnejší liek. V praxi má zavedenie takýchto systémov následok pokles cien liekov, ktorých cena presahuje limit referenčnej úhrady (Lopez-Casasnovas a Puig-Juno 2000).
Referenčný systém úhrad vo všeobecnosti slúži trom účelom:
- je nástrojom na motivovanie lekárov a pacientov používať lacnejšie lieky v rámci terapeutickej skupiny a tým znižovať náklady aj pre spoločnosť
- motivujú výrobcu drahších liekov k zníženiu cien
- informujú predpisujúceho lekára aj pacienta o existencii možných alternatív
Z týchto dôvodov, sú systémy referenčných úhrad široko používaným opatrením, zvyčajne v kombinácii s pozitívnym zoznamom.
Referenčný systém úhrad vyžaduje klasifikáciu liekov do viac či menej homogénnych skupín podobných produktov, ktoré môžu byť považované za zameniteľné pri liečbe (clustrovanie) a následne stanovenie maximálnej úhrady pre každú skupinu (cluster). Podľa homogénnosti clustrov sa rozlišuje generický referenčný systém, kedy sa do jednej skupiny (clustra) liekov zaraďujú len alternatívne originálne a generické verzie toho istého lieku, alebo môže ísť o širšie skupiny, terapeutický referenčný systém, kedy sa do jednej skupiny zaraďujú lieky s rôznymi účinnými látkami, ale s terapeutickou zameniteľnosťou (vytvárajú sa „jumbo“ clustre).
Úhrada v referenčnej skupine je zvyčajne určená cenou najlacnejšieho lieku, ale môže byť stanovená aj v inej výške v závislosti na cenách jednotlivých zástupcov v skupine (priemerná cena liekov v skupine, cena, ktorá zabezpečuje isté percento spotrebovaných liekov bez spoluúčasti alebo sa úhrada volí naopak tak, aby aj najlacnejší liek mal istú spoluúčasť).
Referenčný systém úhrad sa preukázal ako úspešný pri stimulácii k nízkonákladovému predpisovaniu liekov, pri znižovaní cien liekov a pri vytváraní konkurencie na farmaceutickom trhu všeobecne. Je použiteľný pre rozsiahlu oblasť farmaceutického trhu, ale jeho výhody sa strácajú pri vysoko inovatívnych originálnych liekoch, ktoré nie je možné zaradiť do skupiny s inými liekmi. Ich úspešnosť závisí najmä na definícii clusterov, ktoré musia obsahovať primerane zameniteľné lieky.
V EÚ je referenčný systém úhrad používaný veľmi často, pretože je efektívny pri znižovaní cenových rozdielov medzi liekmi definovanými ako terapeuticky nahraditeľné a zlepšuje trhovú transparentnosť (Giuliani et al. 1998). Systémy medzi krajinami sa líšia v rozsahu, určovaní výšky úhrad aj spôsobe definovania skupín zameniteľných liekov a v tom, či sa týkajú aj originálnych alebo len generických liekov. V Dánsku, Nemecku a Španielsku (a Švédsku až do októbra 2002) referenčné systémy úhrad zahŕňali iba lieky po skončení patentovej ochrany. Holandsko naopak zahŕňa patentované lieky v celom referenčnom systéme úhrad a tvorí široké referenčné skupiny terapeuticky ekvivalentných liekov. Rok zavedenia referenčného systému úhrad vo vybratých krajinách EÚ a popis systémov je v Tabuľke 2.
Aj keď zavedenie referenčného systému úhrad viedlo k zníženiu nákladov na lieky, tento efekt bol často krátkodobý (napr. v Holandsku (Lopez-Casasnovas a Puig-Juno 2000), Nemecku (Nink et al. 2001) a Taliansku (Donatini et al. 2001)). Jedným z vysvetlení je, že zvýšenie objemu a cien liekov mimo referenčného systému úhrad prevážilo znižovanie farmaceutických výdavkov za lieky v systéme. Niektorí nemeckí lekári napríklad prednostné predpisovali lieky, ktoré neboli zahrnuté v referenčnom systéme, aby sa vyhli diskusii s pacientom o výške spoluúčasti (Nink et al. 2001). V počiatočných fázach zavádzania tohto systému v Nemecku sa ceny liekov mimo referenčného systému zvýšili o viac ako 20 percent (Statistisches Bundesamt, 1998). Tieto popísané efekty sú však úzko späté s charakteristikami jednotlivých systémov referenčných úhrad a možnosť prenosu skúseností z iných krajín je obmedzená.
Tabuľka 2: Porovnanie definícií systémov referenčných úhrad vo vybraných krajinách EÚ
|
Krajina |
Rok zavedenia |
Definícia referenčnej úhrady |
|
Nemecko |
1989 |
Štatisticky vypočítaný medián ceny liekov, ktoré obsahujú rovnakú účinnú látku a majú porovnateľnú účinnosť |
|
Holandsko |
1991 |
Priemerná cena liekov s podobnými terapeutickými účinkami |
|
Dánsko |
1996 |
Najnižšia cena generického ekvivalentu na trhu |
|
Španielsko |
2000 |
Aritmetický priemer troch liekov s najnižšími nákladmi na DDD zoskupené podľa zloženia |
|
Belgicko |
2001 |
Cena, ktorá je o 26 percent nižšia ako pôvodná cena originálneho lieku pred vstupom generík na trh |
|
Taliansko |
2001 |
Najnižšia cena generického ekvivalentu na trhu |
|
Portugalsko |
2003 |
Najnižšia cena generického ekvivalentu na trhu |
Zdroj: Mossialos, Mrazek a Walley, 2004
4. Predaj a distribúcia liekov
Výdaj liekov pacientom je tiež významne regulovaný. Pacient si môže lieky zakúpiť často len v lekárňach. Niektoré krajiny majú povolený predaj voľnopredajných liekov aj mimo lekární. V rámci EÚ spoločná legislatíva stanovuje, že pri výdaji lieku na recept musí byť kvalifikovaný lekárnik a že výdaj takýchto liekov môže byť realizovaný iba prostredníctvom licencovaných lekární. Regulačné orgány v jednotlivých štátoch môžu rozhodnúť, aké ďalšie výrobky sa môžu predávať v lekárňach, kto ešte môže predávať lieky, ako je nastavená marža lekárnikov a to, čo môžu lekárnici vydávať na základe lekárskeho predpisu. To, čo môže lekárnik vydať pacientovi závisí od toho, čo je napísané na recepte a či je povolená generická substitúcia liekov.
Vo väčšine členských štátov EÚ pochádza podstatná časť príjmov lekárnikov z ich obchodnej prirážky z výdaja liekov na predpis, teda tiež z verejného zdravotného poistenia. Keďže ide o verejné zdroje, sú ich obchodné prirážky spravidla regulované vládami.
Obchodná prirážka distribútorov a lekární býva regulovaná buď priamo (stanovenie pravidiel, akú sumu si môžu pripočítať k cene lieku) alebo nepriamo, kedy sa reguluje maximálna konečná cena lieku a výška príjmu distribútora a lekárne závisí od ich schopnosti efektívne lieky nakúpiť a možnosti obstáť v konkurenčnom boji s ostatnými distribútormi a lekárňami. Pri priamej regulácii môže byť obchodná prirážka stanovená percentuálne (teda ako maximálne percento z ceny lieku) alebo degresívne. Degresívna obchodná prirážka znamená, že percento prirážky klesá so zvyšujúcou sa cenou lieku. Extrémnou formou degresívnej prirážky používanej pri liekoch je fixná nominálna suma, ktorá je rovnaká bez ohľadu na cenu lieku. Degresívna prirážka na rozdiel od percentuálnej prirážky nemotivuje distribútorov a lekárnikov predávať a držať na sklade čím najdrahšie lieky, lebo lepšie zohľadňuje v zásade podobné náklady potrebné na manipuláciu s liekom. Keďže väčšinou aj napriek degresii prirážka nominálne stúpa, zohľadňujú sa tým zároveň náklady distribútora alebo lekárnika, ktoré potrebuje na obstaranie lieku.
Niektoré krajiny prísne regulujú aj vstup nových lekární na trh. Okrem splnenia bežných odborných požiadaviek na vedenie lekárne, napríklad v Austrálii nesmie byť otvorená lekáreň do vzdialenosti 2 km od inej lekárne a môže sa presúvať bližšie k existujúcim lekárňam maximálnou rýchlosťou 1 km za 2 roky.
5. Predpisovanie a užívanie liekov
5.1 Predpisovanie liekov
Lieky vo veľkej miere môžu byť legálne získané len na základe predpisu lekára. Z pohľadu možnosti získania lieku pacientom sa rozlišujú 2 typy liekov. Lieky viazané na lekársky predpis môže pacient získať len na priame odporučenie lekára, ktoré sa realizuje lekárskym predpisom. Tzv. voľnopredajné lieky (označované aj ako OTC lieky z anglického „over-the-counter“) si spotrebiteľ môže zakúpiť aj z vlastného uváženia. V niektorých krajinách je možné si voľnopredajné lieky zakúpiť aj mimo lekárne (napr. v supermarkete). Rozhodnutie, či liek nebude viazaný na lekársky predpis vydáva regulačný úrad pre vstup liekov na trh a to v takých prípadoch, ak sa pri lieku dostatočnými skúsenosťami preukázalo minimálne riziko toxicity a ktorého používanie nevyžaduje radu lekára.
Preskripcia liekov závisí vo veľkej miere na správaní sa konkrétnych lekárov alebo zdravotníckych zariadení. Farmaceutický trh je nedokonalý s významnými informačnými asymetriami, čo znamená, že spotrebitelia nemajú dostatočné informácie na to, aby sa mohli čo najlepšie rozhodnúť o výbere lieku v záujme vlastného zdravia. Rozhodnutie o výbere lieku je preto vo veľkej miere presunuté na lekára. Farmaceutický trh si preto vyžaduje zásah regulátora nielen na strane ponuky, ale aj dopytu. Cieľom regulácií je ovplyvniť správanie lekárov tak, aby bolo v súlade s racionálnym predpisovaním liekov.
Pri každom predpisovaní liekov musí lekár urobiť dve rozhodnutia – či vôbec liek predpíše, a ak áno, ktorý je pre pacienta najvhodnejší. Ovplyvniť prvé rozhodnutie je oveľa ťažšie než druhé. Lekárove znalosti o stave pacienta a jeho najvhodnejšom riešení nemusia nevyhnutne znamenať primerané správanie sa (napr. časté predpisovanie antibiotík pri nebakteriálnych infekciách horných dýchacích ciest). Predpísanie lieku posilňuje odbornú a expertnú rolu lekára a poskytuje pacientovi aj lekárovi pocit existencie jednoznačnej diagnózy a liečba potvrdzuje pacientovu chorobu (Comaroff 1976). To je častý prípad práve pri predpisovaní antibiotík. V jednej škandinávskej štúdii (Cars a Håkansson 1995) sa percento pacientov, ktorým jednotliví praktickí lekári v rámci jednej praxe predpisovali antibiotiká, pohybovalo od 21 do 76 % pacientov. Tieto rozdiely medzi lekármi sa zásadne nezmenili ani vplyvom prebiehajúceho vzdelávania na túto tému. Autori dospeli k záveru, že lekári majú veľmi individuálne a konštantné vzory pri predpisovaní antibiotík. To naznačuje, že názory a správanie lekárov pri predpisovaní sú stabilné a konzistentné v čase (Taylor a Bond 1991). To je potrebné brať do úvahy pri implementácii opatrení s cieľom zmeniť správanie lekárov.
Racionálne používanie liekov si vyžaduje, aby pacienti dostávali lieky zodpovedajúce ich klinickej potrebe, v dávkach, ktoré spĺňajú ich individuálnu potrebu, na dostatočne dlhý čas a za čo najnižšie náklady na nich aj verejné zdroje. Racionálne používanie liekov podporuje kvalitu starostlivosti a nákladovú efektívnosť. Pomáha zabezpečiť, aby boli lieky použité len v prípade, keď sú potrebné.
Všetky lieky, vrátane esenciálnych liekov, môžu byť použité iracionálne. Iracionálne použitie liekov je rozšírené vo všetkých krajinách a vyskytuje sa ako vo verejnom, tak aj v súkromnom sektore. Iracionálne používanie liekov má zdravotné aj ekonomické dôsledky. Nevhodná liečba môže viesť k zbytočnému utrpeniu a smrti, k jatrogénnym ochoreniam, hospitalizáciám a zvýšeniu antimikrobiálnej rezistencie. Iracionálne užívanie liekov tiež znižuje dôveru verejnosti v systéme zdravotnej starostlivosti a mieru účasti pacientov na liečbe a pri prevencii. Ekonomicky vedie iracionálne užívanie liekov k plytvaniu zdrojov a zníženiu dostupnosti základných liekov v iných oblastiach, kde môžu byť potrebné.
Opatrenia na presadzovanie racionálneho používania liekov sú často kontroverzné a rôzne strany môžu byť z rôznych dôvodov proti nim. Predpisujúci lekári môžu mať finančný záujem na predpisovaní alebo môžu byť proti akémukoľvek zásahu do ich slobody predpisovať. Lekárnici a predajcovia liekov majú finančný záujem na raste objemu nimi predávaných liekov. Výrobcovia chcú zvýšiť predaj svojich produktov a ich marketingové praktiky môžu byť v rozpore s cieľmi racionálneho používania liekov. Spotrebitelia a predpisujúci lekári môžu negatívne vnímať zásahy na podporu racionálneho používania liekov, najmä ak majú pocit, že sú určené skôr na zníženie nákladov, než na zlepšenie liečby. Pri zavádzaní takýchto opatrení Je dôležité identifikovať a zvážiť všetky tieto rôzne záujmy, ktoré sú základné prekážky pre zmeny.
Regulačné autority sa stretávajú s mnohými problémami pri snahe kontrolovať náklady na lieky – zdravotné potreby obyvateľstva, požiadavky pacientov a lekárov na predpisovanie. Lekári sú v ťažkej pozícii, keď konajú ako zástupcovia pacienta pri plnení ich zdravotných potrieb a niekedy aj požiadaviek a zároveň často aj ako zástupcovia platiteľa. Lekári nemusia mať žiadne priame záujmy vo vzťahu k nákladom nimi predpisovaných liekov, pretože za ne neplatia. Toto im na jednej strane umožňuje relatívne nezávisle radiť pacientom, na druhej starne nemusia byť ich odporúčania v súlade so záujmami platiteľa, alebo dokonca zdravotníctva. Lekári sú pri preskripcii vystavení mnohým vplyvom, niekedy aj nevhodným požiadavkám od pacientov: pacienti môžu pomerne ľahko zmeniť svojho lekára, pre lekára pacient predstavuje zdroj príjmov a preto sa môže snažiť zachovať si jeho priazeň splnením jeho oprávnených aj neoprávnených očakávaní, inak môže prísť o pacienta a tým aj príjem.
Opatrenia na strane dopytu majú zvyčajne formu terapeutických odporúčaní alebo reštrikcií toho, ktorý lekár môže čo predpisovať. Niektoré krajiny používajú limity na predpisované lieky pre lekárov alebo poskytujú finančné stimuly na dosiahnutie želaného správania lekárov (napr. zvýšenie podielu generických liekov). V niektorých prípadoch dostáva poskytovateľ fixnú sumu z verejných zdrojov, z ktorej musí zabezpečiť zdravotnú starostlivosť pre svojich pacientov vrátane nákladov na lieky. Takýto model dáva lekárovi silné stimuly na zvažovanie potreby liekov (napr. všeobecní lekári vo Veľkej Británii). Tieto systémy sa spoliehajú na to, že konkurencia medzi lekármi zabezpečí udržanie kvality poskytovanej zdravotnej starostlivosti.
Akýkoľvek pokus o zmenu správania predpisujúceho lekára sa musí zamerať na vytváranie zisku pre pacienta, lekára a samozrejme aj platiteľa. Problém pri hodnotení účinnosti týchto zásahov je v tom, že zásahy sa zriedka používajú jednotlivo. Vo všeobecnosti platí, že presvedčiť lekárov je ťažké (Lohr et al. 1998) a drahé. Existuje spektrum opatrení na ovplyvnenie preskripcie. Z analýz vyplýva, že ak sa použijú jednotlivo, majú malý a neistý účinok. Pri kombinácii a ich opakovanom používaní majú väčšiu šancu na úspech. Samotné vytváranie napr. terapeutických odporúčaní nezmení správanie lekárov, rovnaký dôraz sa musí klásť na stratégie pre realizáciu týchto usmernení. Využitie počítačových programov pri podpore rozhodovania môže byť účinné, ale je náročné na implementáciu.
V Európe prevláda postoj, že výber lieku je plne v kompetencii lekára a táto sloboda je horlivo chránená. V Európskych krajinách existuje len málo neobíditeľných obmedzení týkajúcich sa výberu lieku, pokiaľ sú už zaradené medzi hradené lieky. Opatrenia sa skôr týkajú dĺžky obdobia, na ktoré môžu byť predpísané lieky, a niekedy počtu položiek na recepte.
5.2 Užívanie liekov
Pacienti majú priamy záujem na výsledku predpísanej liečby a často sa podieľajú aj na ich nákladoch. Vo väčšine krajín EÚ je podiel pacienta na celkových nákladoch na lieky relatívne nízky. Úloha pacienta pri výbere lieku počas konzultácie u lekára je spravidla veľmi malá a zriedkavo s lekárom diskutujú o alternatívnych spôsoboch liečby alebo o rôznych nákladoch s tým spojených. Ani v lekárni pacient aj napriek povolenej generickej substitúcii sa nezvykne podieľať na výbere konkrétneho lieku. Pacienti nie sú spotrebitelia v tom zmysle ako to platí na väčšine trhov.
V prípade nadužívania liekov je za to niekedy čiastočne zodpovedný aj pacient, keď trvá na tom, aby mu lekár predpísal liek, aj keď to sám lekár nepovažuje za potrebné. Istú úlohu pri tom hrajú mylné predstavy o liekoch všeobecne alebo o konkrétnych prípravkoch. Tieto mylné predstavy môžu byť dlhodobé, ale môžu byť aj podporované farmaceutickým marketingom, ktorý často poskytuje len čiastočné informácie o produktoch. Naopak pacient môže mať z liekov strach alebo nevedieť, ako ich správne užívať, čoho výsledkom môže byť, že ich užíva nedostatočne alebo vôbec. Nedostatočné podriadenie sa („non- compliance“) je rozšírený problém, ktorého následkom môže byť aj plytvanie zdrojov, a to buď preto, že lieky zostávajú nevyužité alebo preto, že choroba sa zbytočne predĺži. Zatiaľ čo existuje aj „inteligentná non-compliance“, ktorou má pacient možnosť korigovať niektoré iracionálne preskripcie, ideálny výsledok je ten, keď sa pacient aj lekár dohodnú na tom, ktorá terapia je najvhodnejšia.
V poslednej dobe sa mení vzťah medzi lekárom a pacientom. Pacienti sa viac zapájajú do výberu liečby a majú ľahko prístupné množstvo podrobných lekárskych informácií prostredníctvom kníh, médií a internetu. Veľa pacientov má preto menšiu dôveru v lekárov. Navyše v prostredí zameranom na kontrolu nákladov na zdravotnú starostlivosť, majú pacienti väčšiu mieru spoluúčasti, čo ich motivuje k starostlivosti o ľahké ochorenia bez konzultácie s lekárom pomocou voľnopredajných liekov.
Národné a regionálne populácie sa líšia v tom, ako vnímajú svoje ochorenie, čím ovplyvňujú spôsob riešenia chorôb, preto aj spotreba zdravotnej starostlivosti a liekov sa medzi jednotlivými kultúrami a národmi líši. Rozdiely sú pozorované v akceptácii generík, „požičiavania“ liekov, adherencii k liečbe, samomedikácii aj vo vyhľadávaní informácií. V niektorých spoločnostiach samotný akt predpísania lieku lekárom vysiela signál, že návšteva pacienta je skončená a choroba je reálna, preto pacient má pocit nedostatočnej starostlivosti, pokiaľ odchádza od lekára bez receptu. Pacienti musia byť lekárom informovaní o výhodách a obmedzeniach konkrétnych liekov v jasnej a zrozumiteľnej podobe.
Je zrejmé, že vzťah medzi pacientmi a ich liekmi sa vyvíja. Hoci lieky a ich použitie je ovplyvňované históriou a kultúrou, nové trendy sa objavujú v celom vyspelom svete. Tieto trendy presúvajú viac informácií a moci na pacientov. Regulácie, ktoré majú udržať kontrolu informácií alebo liekov v rukách profesionálov sú zrejme odsúdené na neúspech. Príliš liberálna politika však tiež môže byť nebezpečná pre pacienta. Lieky používané nesprávne môžu pacientom ublížiť. Okrem toho pri nedostatočnej regulácii môže farmaceutický priemysel vytvárať umelý dopyt po liekoch, ktoré aj v prípade malého alebo žiadneho ohrozenia zdravia vedú k spotrebe zdrojov na zdravotnú starostlivosť, ktoré by mohli byť využité lepšie na iné typy intervencií pre závažnejšie zdravotné problémy. Preto je dôležité, aby pri vzdelávaní verejnosti a poskytovaní lepšieho prístupu k informáciám o liekoch, boli informácie podávané v rámci širšieho chápania liekov vrátane ich výhod a nevýhod.
6. Náklady na lieky a ich vývoj
V posledných desaťročiach došlo k významnému zvýšeniu verejných výdavkov na lieky, ktoré presahuje rast verejných výdavkov na zdravotníctvo alebo rast HDP. Zabezpečenie finančnej udržateľnosti sa tak stalo primárnym záujmom regulátorov a väčšina používaných opatrení je zameraná v prvom rade na kontrolu nákladov. Vyvinula sa tak komplexná škála regulácií, ktoré sa usilujú nielen kontrolovať verejné rozpočty, ale aj zvýšiť dostupnosť liekov, pri zachovaní motivácií pre farmaceutické spoločnosti prichádzať s novým výskumom, vývojom a inováciami.
Rast verejných výdavkov na lieky bol vo všeobecnosti v krajinách EÚ vyšší ako rast súkromných výdavkov. V niektorých krajinách, najmä tých, ktoré mali nižší nárast celkových výdavkov na lieky, sa dokonca podiel súkromných výdavkov za posledných 10 rokov znížil. V EÚ predstavujú verejné výdavky na lieky priemerne dve tretiny celkových výdavkov na lieky, ale medzi krajinami sú pomerne veľké rozdiely.
Dôvody nárastu nákladov na lieky sú spôsobené faktormi na strane ponuky aj dopytu. Faktory na strane ponuky sú:
- inovatívne lieky s reálnym klinickým prínosom spĺňajúce existujúce neuspokojené zdravotné potreby zvyšujú náklady prostredníctvom vyšších cien a nových objemov, s výnimkou prípadov, kedy je tento účinok kompenzovaný tým, že predchádzajúca liečba je zastaraná,
- aj ak klinický prínos nového lieku voči starému je len okrajový, výrobcovia budú investovať do marketingu na zmenu dopytu na drahší spôsob liečby
- vlády majú tendenciu k regulácii cien liekov, ale niektoré z týchto opatrení nie sú ekonomicky príliš efektívne; nedostatok rokovacích schopností alebo informácií niekedy sťažuje verejnému sektoru konkurovať súkromnému sektoru
- nedostatok konkurencie, napríklad v dôsledku príliš zložitého prístupu na trh alebo malého rozsahu trhu (trh je príliš malý, aby bol atraktívny pre viacero výrobcov)
- nedostatok transparentnosti: vládni úradníci rozhodujúci o vstupe na trh, cene a úhrade sú potenciálnym cieľom pre korupciu
- národná hospodárska politika interferujúca s opatreniami na kontrolu nákladov – v prípade, ak domáci výrobcovia sú zvýhodňovaní pred zahraničnými, kedy by nákup liekov v zahraničí ušetril verejné zdroje
- v mnohých krajinách existujú stimuly smerujúce k používaniu viacerých alebo drahších liekov (napríklad tým, že sa umožní lekárom vydávať lieky alebo sú marže lekární stanovené ako percento z ceny)
Faktory ovplyvňujúce rast nákladov na strane dopytu:
- rast objemu je ovplyvnený starnutím populácie s vyššou chorobnosťou, ale aj rastúcou kúpnou silou v mnohých krajinách: zvyčajne platí, že dopyt po zdravotnej starostlivosti rastie rýchlejšie než HDP; dôvodom je pravdepodobne to, že zdravie je prioritou pred inými oblasťami verejnej a súkromnej spotreby
- nedostatok dôvery v systéme regulácie môže zvyšovať dopyt po drahších originálnych liekoch dovážaných z vyspelých krajín
- marketing a propagačné aktivity farmaceutických firiem stimulujú dopyt cez predpisujúcich lekárov, a prípadná priama reklama voči pacientom- spotrebiteľom
- mylné predstavy o tom, čo je optimálna liečba a nedostatok guidelineov pre lekárov vedie k zbytočnému predpisovaniu liekov
- informačná asymetria a fragmentácia na strane spotrebiteľov, nedostatok organizačných kapacít pre hodnotenie kvality a nákladovej efektívnosti liečby
- zmeny v poskytovaní zdravotnej starostlivosti môžu viesť k zmene alokácie zdrojov v zdravotníctve; zmena z hospitalizačnej na ambulantnú starostlivosť v niektorých prípadoch (napr. pri jednodňovej chirurgii) môže znížiť celkové náklady znížením nákladov na drahú hospitalizáciu, ale môže znamenať nárast výdavkov na lieky v ambulantnom sektore
Keďže v prípade liekov na predpis konečný spotrebiteľ má malú motiváciu kontrolovať svoju spotrebu, zodpovednosť za kontrolu nákladov a efektívne používanie liekov padá na reguláciu štátom alebo na zdravotnú poisťovňu. Existujú rôzne mechanizmy, ktoré regulátor alebo zdravotné poisťovne môžu použiť na zabezpečenie nákladovo-efektívnej spotreby liekov, vrátane využívania spoluúčasti, formulárov, reguláciu cien liekov a ovplyvňovania predpisujúcich lekárov alebo farmaceutov.
Úspory vytvorené opatreniami sú však často limitované a ich efekt je len krátkodobý. Aj najúčinnejšie opatrenia fungujú najlepšie vtedy, ak sú kombinované s inými regulačnými opatreniami. Napríklad regulácia cien má len obmedzený vplyv, ale jej efekt sa zvyšuje, ak je doplnená opatreniami aj na strane dopytu.
V skutočnosti len pri malej časti regulačných opatrení sa preukázala účinnosť na kontrolu nákladov alebo zvýšenie efektivity, čo je ale aj dôsledkom chýbajúceho výskumu. Zvýšenie efektivity je pritom často kľúčovým cieľom regulačných opatrení- obsahuje v sebe kontrolu nákladov bez zníženia kvality. Medzi týchto pár opatrení, ktorých vplyv na zvyšovanie efektivity bol preukázaný, patrí generická preskripcia alebo generická substitúcia.
Zdroje
-
Abel-Smith B., Grandjeat P.: Pharmaceutical consumption: Trends in expenditure, main measures taken and underlying objectives of public intervention in this field. Commission of the European Communities. 1978; 102.
-
Berndt, T.J., Keefe, K.: Friends’ influence on adolescents’ adjustment to school. Child Development. 1995; 66: 1312-1329.
-
Cars H., Håkansson A.: To prescribe–or not to prescribe–antibiotics. District physicians‘ habits vary greatly, and are difficult to change. Scand J Prim Health Care. 1995; 13(1): 3-7.
-
Comaroff J.: A Bitter Pil to Swallow: Placebo Therapy in General Practice. The Sociological Review 1976; 24(1): 79–96.
-
Danzon P.M., Epstein A., Nicholson S: Mergers and Acqusitions in the Pharmaceutical and Biotech Industries. Managerial and Decision Economics 2007; 28(4/5): 307-328.
-
DiMasi J.A., Hansen R.W., Grabowski H.G., Lasagna L.: Research and Development Costs for New Drugs by Therapeutic Category: A Study of the US Pharmaceutical Industry. PharmacoEconomics 1995; 7, 152–169.
-
Donatini, A., Rico, A., D’Ambrosio, M.G. et al.: Health Care Systems in Transition: Italy. Copenhagen: European Observatory on Health Care Systems 2001.
-
Dukes G., Haaijer F., Joncheere C., Rietveld A.: Drugs and Money: Prices, Affordability and Cost Containment. Amsterdam: IOS Press 2003.
-
Ellison S.F. Cockburn I., Griliches Z., Hausman J.: Characteristics of Demand for Pharmaceutical Products: An examination of Four Cephalosporins. RAND Journal of Economics 1997; 28: 426-446.
-
Garattini S. Bertele V.: Efficacy, safety, and cost of new anticancer drugs. British Medical Journal 2002; 325: 269–71.
-
Giuliani G., Selke G., Garattini L.: The German experience in reference pricing. Health Policy 1998; 44: 73–85.
-
Jacobzone S.: Labour Market and Social Policy. Occasional Papers No. 40. Pharmaceutical Policies In OECD Countries: Reconciling Social and Industrial Goals. Paris: OECD 2000.
-
Kaitin I.K., Manocchia M., Seibring M., Lasagna L.: The New Drug Approvals of 1990, 1991, and 1992: Trends in Drug Development. The Journal of Clinical Pharmacology 1994; 34(2): 120–127.
-
Lohr K.N., Eleazer K., Mauskopf J.: Health policy issues and applications for evidence-based medicine and clinical practice guidelines. Health Policy 1998; 46: 1–19.
-
Lopez-Casasnovas G., Puig-Junoy J.: Review of the literature on reference pricing. Health Policy 2000; 54(2): 87–123.
-
Mossialos E., Mrazek M., Walley T.: Regulating pharmaceuticals in Europe: striving for efficiency, equity and quality. Open University Press, Buckingham, UK 2004.
-
Nefarma: Market Data: Drugs Use in International Perspective. Annual Report. The Hague: Nefarma 2002.
-
Nink K., Schroder H., Selke G.W.: Der Arzneimittelmarkt in der BDR [The pharmaceuticals market in the Federal Republic of Germany], in U. Schwabe and D.Paffrath (eds) Arzneiverordnungs-Report 2001. Berlin: Springer 2001.
-
Peltzman S.: An Evaluation of Consumer Protection Legislation: The 1962 Drug Amendments. Journal of Political Economy 1973; 81(5): 1049-1091.
-
Scherer F.M.: Comment. In: Helms RB, ed. Competitive Strategies in the Pharmaceutical Industry. Washington, DC: American Enterprise Institute 1996, 269-73.
-
Statistisches Bundesamt Gesundheitsbericht für Deutschland: Pharmazeutische und medizinische Industrie [The Pharmaceuticals and Medicinal Products Industry], Wiesbaden: Statistisches Bundesamt 1998.
-
Taylor R.J., Bond C.M.: Change in the established prescribing habits of general practitioners: an analysis of initial prescriptions in general practice. British Journal of General Practice 1991; 41: 244–8.
[1] Vo Veľkej Británii je napríklad úloha rozhodovania o úhrade v rámci Národnej zdravotnej služby (NHS) pridelená NICE, ktorý však nie je zodpovedný za financovanie nových technológií a neberie do úvahy ich dostupnosť – jeho rozhodnutie preto môže predstavovať vážne problémy pre poskytovateľov zdravotnej starostlivosti, ktorí majú obmedzený rozpočet. Odporúčania NICE sú jedným z hlavných dôvodov nárastu nákladov na lieky v NHS v posledných rokoch.
Prihláste sa na odber newslettera
Newsletter
Počet lekární rastie. Zlepšuje sa dostupnosť?
Analýza lekárenského trhu v SR a v ČR
Odvodový bonus v kontexte reformy verejného zdravotného poistenia
Rozpočet: prekvapenie sa nekoná
Od
Tomáš Szalay
Mezinárodní porovnání mezd lékařů a sester
Vnitřní diferenciace mezd lékařů a sester v České republice
Relativní mzdy v sektoru zdravotnictví
Zmeny prídu až po voľbách
Od
Tomáš Szalay
Monitoring
Prečo liečba neplodnosti láka oligarchov
Od
etrend.sk
Zdravotné sestry budú protestovať proti rozkrádaniu zdravotníctva
Od
pravda.sk
Biznis s titulmi: Kto platí, môže byť v testoch aj podpriemerný
Od
projektN.sk
Nemocniciam zavesil Kažimír pred nos 50 miliónov. Bude ich pánom
Od
etrend.sk
Prieskum v piešťanskej nemocnici si každý vysvetľuje po svojom
Od
pravda.sk
Prečítali sme si
- Transparency: Prestanú nemocnice s neefektívnymi nákupmi... zemiakov?
- Transparency: Polovica nemocníc nemá na pacienta čas
- Lekár: Treba iný typ zmeny, viac prístrojov nepomôže
- Na zdravotníckych eurofondoch najviac zarobil Širokého Váhostav
- Analýza Operačného programu zdravotníctvo 2007-2013: Viac verejnej kontroly eurofondov
- Veľké nemocnice nakupovali elektrinu najdrahšie
- Prešetrovanie údajnej štátnej pomoci pre SZP a VšZP [pdf]
developed by enscope, s.r.o.




